


profesional sanitario
La tolerabilidad, eficacia y seguridad de KOSELUGO® han sido evaluadas en un ensayo de fase II de un brazo, abierto y multicéntrico (SPRINT) en 50 pacientes pediátricos del estrato 1 con Neurofibromatosis Tipo 1 (NF1) y neurofibromas plexiformes (NP) inoperables que causaban una morbilidad significativa.1-3
El estudio SPRINT está en curso. Los resultados de eficacia se presentan basados en un corte de datos de marzo de 2021.3
Criterios de inclusión:4,5
- Edad 2-18 años.
- Diagnóstico de NF1 y al menos un NP inoperable, sintomático y medible.
- Se definió como NP inoperable el NP que no se puede extripar quirúrgicamente por completo sin riesgo de morbilidad sustancial debido a encapsulado o proximidad cercana a estructuras vitales, invasividad o alta vascularización de NP.
- NP medible se definió como un NP de al menos 3 cm medidos en una dimensión y adecuado para resonancia magnética volumétrica.
- ≥ 1 complicación relacionada con el NP.
- Capaces de tragar cápsulas intactas.
- Otros*
Criterios de exclusión:4,5
- Uso de un agente en investigación en los últimos 30 días.
- Mujeres embarazadas o en periodo de lactancia debido a un riesgo potencial de efectos adversos fetales y teratogénicos.
- Evidencia de radioterapia, quimioterapia, terapia hormonal dirigida al tumor, inmunoterapia o terapia biológica en curso.
- Enfermedad sistémica clínicamente significativa, no relacionada y no controlada.
- Otros*
Variables secundarias
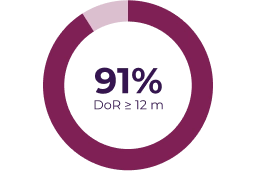
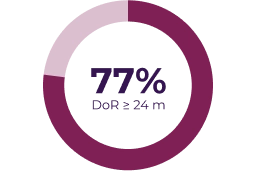
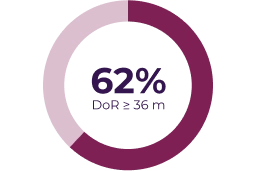



La respuesta parcial se definió como reducción del volumen del NP diana > 20% respecto a la evaluación basal (línea discontinua) y la enfermedad progresiva se definió como incremento del volumen del NP diana > 20% respecto a la evaluación basal o la mejor respuesta si hubo una respuesta parcial.3

▼ Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospecha de reacciones adversas asociadas a este medicamento.
PRESENTACIÓN Y PRECIO: Koselugo® 10 mg cápsulas duras, 60 cápsulas. C.N: 731322. PVL notificado: 5.400 €. Koselugo® 25 mg cápsulas duras, 60 cápsulas. C.N: 731324. PVL notificado: 13.500 €. Financiación por el S.N.S restringida a determinadas indicaciones/condiciones.
RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN: Medicamento sujeto a prescripción médica. Diagnóstico hospitalario.
Consulte la Ficha Técnica completa antes de prescribir este medicamento.