


Ensayo clínico fase 3, multicéntrico en pacientes con HPN que han recibido tratamiento previo*1-3
Figura elaborada por Alexion en base a los valores no representados gráficamente en las publicaciones Kulasekararaj AG, et al. BIood. 2019.1 y KulasekararaJ AG, et al. Eur J Haematol. 2021.3
*Estudio clínico fase 3 de no inferioridad.
HPN: hemoglobinuria paroxística nocturna.Tabla de: Kutasekararaj AG, et al, Blood. 2019.1
*Rango normal: 120 a 246 un.**No disponible
†Rango normal: 11,5 a 16.0 g/dl (mujeres) y 13,0 a 17,5 g/dl (hombres).
LDH: lactato deshidrogenasa; CGR: concentrado de glóbulos rojos; HPN: hemoglobinuria paroxística nocturna; DE: desviación estándar.

Figura de: Kulasekararaj AG, Hill A, Langemeijer S, et al. 2021;106(3):389-397.3
Concentraciones de C5 libre inferiores a 0,5 μg/ml se correlacionaron con máximo control de la hemólisis intravascular e inhibición completa del complemento en los estudios clínicos. Las líneas horizontales discontinuas indican concentraciones séricas de C5 libre de 0,5 μg/ml. La línea horizontal en el medio de cada cuadro es la mediana; la parte superior e inferior marcan los percentiles 75 y 25, respectivamente. El rombo indica la media y los bigotes representan el recorrido intercuartílico 1,5 del cuartil inferior y del cuartil superior. Los asteriscos representan valores atípicos. El eje Y es una escala logarítmica. Para el grupo de ravulizumab, se utilizaron 0,5 μg/ml para valores de C5 libres que eran BLQ, LLQ/2 = 0. Para el grupo de eculizumab, se utilizaron 0,137 µg/ml para valores de C5 libres que eran BLQ, LLQ/2 = 0. Para el estudio 302, se excluyó la muestra de C5 libre inicial del día 1 de cada grupo de tratamiento, ya que los datos se consideraron biológicamente improbables. Las exclusiones se corroboraron con los datos de C5 libre emparejados, ya que las muestras de C5 libre se obtuvieron de la misma extracción de sangre.BLQ: por debajo del límite de cuantificación; C5: componente 5 del complemento; LLQ: límite inferior de cuantificación; BL: valor basal.
En cambio, en el grupo de Soliris® hubo 7 episodios de hemólisis en brecha, de los cuales 4 se asociaron con niveles de C5 libres.1,5
Gráfica elaborada a partir de la tabla 1 de Brodsky RA, et al. Haematologica. 2021.5
ULTOMIRIS® inhibe completamente C5* desde la primera infusión y de forma sostenida durante los 183 días de tratamiento en todos los pacientes.1,6
El tratamiento con Soliris® no alcanzó la inhibición de C5 de forma consistente en todos los pacientes.Figura de: Kulasekararaj AG, et al. Blood, 2019.1
Media (IC del 95%) de los niveles de C5 libre en los grupos de ravulizumab y eculizumab a lo largo del tiempo, (A-B) Se utilizó un ensayo de fluorescencia para los pacientes que recibieron ravulizumab (A), y un inmunoensayo de electroquimioluminiscencia para los pacientes que recibieron eculizumab (B). EI basal (BL) se definió como el último valor no ausente antes de la primera dosis del fármaco del estudio. Los datos de los días 29, 43, 57, 85, 99, 113, 141, 155 y 169 son de cualquier momento para el grupo de ravulizumab y de antes de la dosis para eI grupo de eculizumab. La línea horizontal indica un nivel de C5 libre de 0,5 μg/ml. Los niveles de C5 libre < 0,5 μg/ml se asocian a una inhibición completa de la actividad de C5.*Inhibición completa de C5: Definida como concentraciones de C5 libre < 0,5 μg/ml.
BL: basal; IC: intervalo de confianza.
PRESENTACIÓN Y PRECIO. Ultomiris 300 mg/3 ml concentrado para solución para perfusión, 1 vial de 3 ml. C.N: 731120. PVL notificado: 5.018 €. Ultomiris 1100 mg/11 ml concentrado para solución para perfusión, 1 vial de 11 ml. C.N: 731121. PVL notificado: 18.399,33 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. La indicación de Trastorno del espectro de neuromielitis óptica (TENMO) no está incluida en la prestación farmacéutica del Sistema Nacional de Salud. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.
Para acceder a la Ficha Técnica de Soliris®, haz click aquí.
PRESENTACIÓN Y PRECIO. Soliris 300 mg concentrado para solución para perfusión, 1 vial de 30 ml. C.N: 659702. PVL notificado: 4.450,00 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. Las indicaciones de Miastenia gravis generalizada (MGg) refractaria y Trastorno del espectro de neuromielitis óptica (TENMO) no están incluidas en la prestación farmacéutica del Sistema Nacional de Salud. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.
Ensayo clínico fase 3, multicéntrico en pacientes sin tratamiento previo.*1,2
Figura elaborada por Alexion en base a los valores no representados gráficamente en las publicaciones de Lee JW, et al. Blood. 20191 y Schrezenmeier H, et al. Ther Adv Hematol. 2020.2
*Estudio clinico fase 3 de no inferioridad.Tabla de: Lee JW, et al. Blood. 2019.1
LDH: lactato deshidrogenasa; DE: desviación estándar; HPN: hemoglobinuria paroxística nocturna.
Figura de: Schrezenmeier H, et al. Ther Adv Hematol. 2020.2
Concentraciones de C5 libre inferiores a 0,5 μg/ml se correlacionaron con máximo control de la hemólisis intravascular e inhibición completa del complemento en los estudios clínicos. Las líneas horizontales discontinuas indican concentraciones séricas de C5 libre de 0,5 μg/ml. La línea horizontal en el medio de cada cuadro es la mediana; la parte superior e inferior marcan los percentiles 75 y 25, respectivamente. El rombo indica la media y los bigotes representan el recorrido intercuartílico 1,5 del cuartil inferior y del cuartil superior. Los asteriscos representan valores atípicos. El eje Y es una escala logarítmica. Para el grupo de ravulizumab, se utilizaron 0,5 μg/ml para valores de C5 libres que eran BLQ, LLQ/2 = 0. Para el grupo de eculizumab, se utilizaron 0,137 µg/ml para valores de C5 libres que eran BLQ, LLQ/2 = 0. Para el estudio 302, se excluyó la muestra de C5 libre inicial del día 1 de cada grupo de tratamiento, ya que los datos se consideraron biológicamente improbables. Las exclusiones se corroboraron con los datos de C5 libre emparejados, ya que las muestras de C5 libre se obtuvieron de la misma extracción de sangre.BL: valor basal; BLQ: por debajo del límite de cuantificación; C5: componente 5 del complemento; LLQ: límite inferior de cuantificación.
Ningún episodio de hemólisis en brecha en el grupo de ULTOMIRIS® fue debido a una inhibición incompleta de C5.1,4
Gráfica elaborada a partir de la tabla 1 de Brodsky RA, et al. Haematologica. 2021.4
ULTOMIRIS® inhibe completamente C5* desde la primera infusión y de forma sostenida durante los 183 días de tratamiento en todos los pacientes.1,5
El tratamiento con Soliris® no alcanzó la inhibición de C5 de forma consistente en todos los pacientes.Figura de: Lee JW. Blood, 2019.1
Concentraciones medias (lC del 95%) de C5 libre en los grupos de ravulizumab y eculizumab a lo largo del tiempo. Los niveles de C5 libre se evaluaron mediante un ensayo de fluorescencia en los pacientes que recibieron ravulizumab y un inmunoensayo electroquimioluminiscente en los pacientes que recibieron eculizumab: en 3 pacientes del grupo de ravulizumab y en 8 del grupo de eculizumab se excluyeron las muestras del día 1 porque se consideraron biológicamente inverosimiles. Los niveles de C5 libre μg/ml se asocian a una inhibición completa de la actividad de C5. Los datos de los días 1, 15, 71 y 127 son de la predosis y del final de la infusión para ambos grupos de tratamiento, mientras que en los días 8, 22, 29, 43, 57, 85, 99, 113, 141, 155 y 169, los datos son de cualquier momento para el grupo de ravulizumab y de la predosis para el grupo de eculizumab; y en el día 183, los datos son del final del periodo de tratamiento aleatorio para ambos grupos de tratamiento. BL. (eI último valor de evaluación no faltante antes de la primera dosis del fármaco del estudio).*lnhibición incompleta de C5 definida como concentraciones de C5 libre < 0,5 μg/ml.
BL: basal; IC: intervalo de confianza.
PRESENTACIÓN Y PRECIO. Ultomiris 300 mg/3 ml concentrado para solución para perfusión, 1 vial de 3 ml. C.N: 731120. PVL notificado: 5.018 €. Ultomiris 1100 mg/11 ml concentrado para solución para perfusión, 1 vial de 11 ml. C.N: 731121. PVL notificado: 18.399,33 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. La indicación de Trastorno del espectro de neuromielitis óptica (TENMO) no está incluida en la prestación farmacéutica del Sistema Nacional de Salud. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.
Para acceder a la Ficha Técnica de Soliris®, haz click aquí.
PRESENTACIÓN Y PRECIO. Soliris 300 mg concentrado para solución para perfusión, 1 vial de 30 ml. C.N: 659702. PVL notificado: 4.450,00 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. Las indicaciones de Miastenia gravis generalizada (MGg) refractaria y Trastorno del espectro de neuromielitis óptica (TENMO) no están incluidas en la prestación farmacéutica del Sistema Nacional de Salud. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.*El único paciente que prefirió eculizumab fue por la "conveniencia del tratamiento", relacionado con el tiempo de infusión más corto comparado con ravulizumab. La formulación comercializada de ravulizumab es de 100 mg/ml, y actualmente iguala los tiempos de infusión a eculizumab. La formulación de los ensayos clínicos que recibieron los pacientes tenía una concentración de 10 mg/mI.1
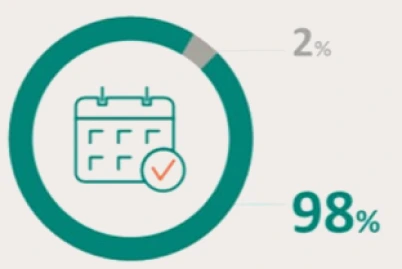
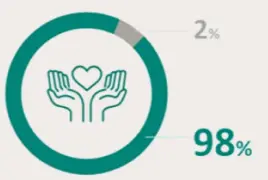
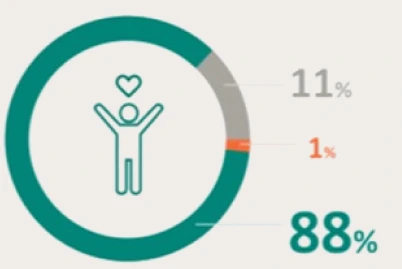
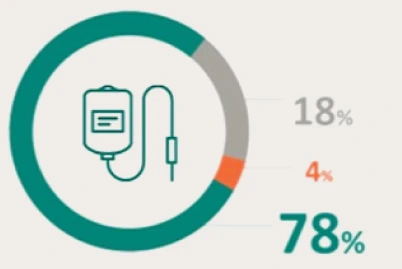
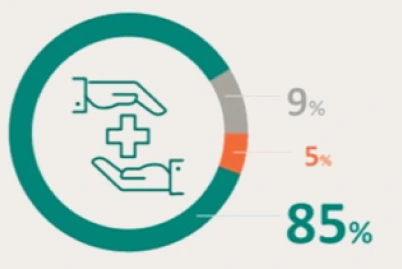
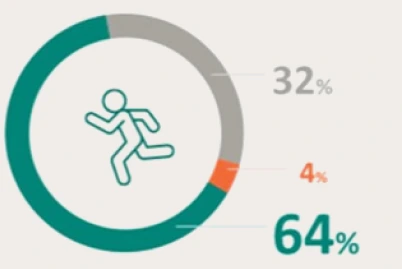
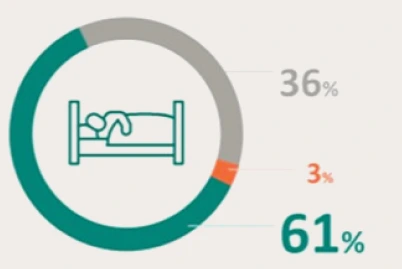
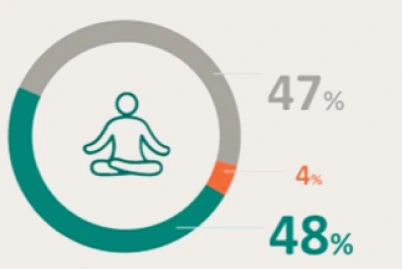
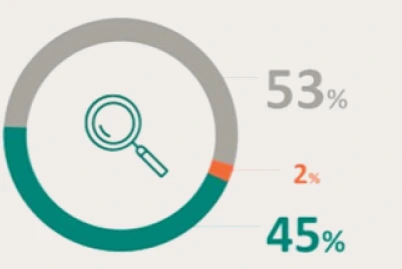
PRESENTACIÓN Y PRECIO. Ultomiris 300 mg/3 ml concentrado para solución para perfusión, 1 vial de 3 ml. C.N: 731120. PVL notificado: 5.018 €. Ultomiris 1100 mg/11 ml concentrado para solución para perfusión, 1 vial de 11 ml. C.N: 731121. PVL notificado: 18.399,33 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. La indicación de Trastorno del espectro de neuromielitis óptica (TENMO) no está incluida en la prestación farmacéutica del Sistema Nacional de Salud. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.
Para acceder a la Ficha Técnica de Soliris®, haz click aquí.
PRESENTACIÓN Y PRECIO. Soliris 300 mg concentrado para solución para perfusión, 1 vial de 30 ml. C.N: 659702. PVL notificado: 4.450,00 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. Las indicaciones de Miastenia gravis generalizada (MGg) refractaria y Trastorno del espectro de neuromielitis óptica (TENMO) no están incluidas en la prestación farmacéutica del Sistema Nacional de Salud. RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.
profesional sanitario
