


* Debido a su mecanismo de acción, el uso de ULTOMIRIS® aumenta la susceptibilidad del paciente a la infección/sepsis meningocócica (Neisseria meningitidis). Para reducir este riesgo de infección, todos los pacientes deben vacunarse contra las infecciones meningocócicas al menos dos semanas antes de iniciar el tratamiento con ULTOMIRIS®
† Se permitió la administración de dosis estables de inhibidores de la acetilcolinesterasa y tratamientos inmunosupresores (incluidos corticosteroides) durante el período controlado aleatorizado. Los cambios de dosis estaban permitidos en el período de extensión abierto.2,3
AChR: receptor de acetilcolina; MGg: miastenia gravis generalizada; OLE: extensión abierta.
* Se permitió la administración de dosis estables de inhibidores de la acetilcolinesterasa y tratamientos inmunosupresores (incluidos corticosteroides) durante el período controlado aleatorizado. Se permitieron cambios de dosis en el período de extensión abierto.2,3

* Se permitió la administración de dosis estables de inhibidores de la acetilcolinesterasa y tratamientos inmunosupresores (incluidos corticosteroides) durante el período controlado aleatorizado. Se permitieron cambios de dosis en el período de extensión abierta.2,3
IST: terapia inmunosupresoraAChR: receptor de acetilcolina; MGg: miastenia gravis generalizada; IgIV: inmunoglobulina intravenosa; MG: miastenia gravis; MGFA: Myastenia Gravis Foundation of America; MG-ADL: escala de actividades de la vida diaria en miastenia gravis
Para acceder a la Ficha Técnica de ULTOMIRIS®, haz click aquí.
PRESENTACIÓN Y PRECIO. Ultomiris 300 mg/3 ml concentrado para solución para perfusión, 1 vial de 3 ml. C.N: 731120. PVL notificado: 5.018 €. Ultomiris 1100 mg/11 ml concentrado para solución para perfusión, 1 vial de 11 ml. C.N: 731121. PVL notificado: 18.399,33 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. La indicación de Trastorno del espectro de neuromielitis óptica (TENMO) no está incluida en la prestación farmacéutica del Sistema Nacional de Salud.RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN. Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.

Figura de: Vu T, et al. N Eng J Med Evid. 2022; 1(5).2
Al cabo de 1 semana de tratamiento, se observaron mejoras en MG-ADL, pero el criterio de valoración principal fue en la semana 26. Por lo tanto, los resultados deben interpretarse con precaución2
Los datos mostrados del estudio CHAMPION-MG son medias de mínimos cuadrados e intervalos de confianza (IC) del 95 %, utilizando un modelo mixto para medidas repetidas; Los IC del 95 % no se ajustaron por multiplicidad.2
* Se permitió la administración de dosis estables de inhibidores de la acetilcolinesterasa y tratamientos inmunosupresores (incluidos corticosteroides) durante el período controlado aleatorizado2
IC: intervalo de confianza; C5: proteína del complemento; MC: mínimos cuadrados; MG-ADL: escala de actividades de la vida diaria en miastenia gravis; DE: desviación estándar.
En el criterio de valoración secundario, la puntuación QMG total desde el inicio hasta la semana 26, se redujo 2,8 puntos tras el tramiento con ULTOMIRIS® vs 0,8 puntos con placebo (P <0,0009).1,2
Figura de: Vu T, et al. N Eng J Med Evid. 2022;1(5).2
* Se permitió la administración de dosis estables de inhibidores de la acetilcolinesterasa y tratamientos inmunosupresores (incluidos corticosteroides) durante el período controlado aleatorizado2
IC: intervalo de confianza; IST: terapia inmunosupresora, MC: mínimos cuadrados; QMG: Quantitative Myasthenia Gravis; DE: desviación estándar.
El período de extensión abierto comenzó después de la semana 26, donde todos los pacientes recibieron ULTOMIRIS® y los resultados se observaron hasta la semana 164.*3a
Figura de: Vu T, et al. Poster presented at: American Academy of Neurology (AAN) Annual Meeting; April 13-18, 2024; Denver, CO.3
* Los pacientes fueron distribuidos alatoriamente para recibir ULTOMIRIS® (n=86) o placebo (n = 89) durante 26 semanas y posteriormente, se les permitió entrar en el período de extensión abierta de hasta 4 años.2
a) CHAMPION-MG OLE (2020-2023) fue el período de extensión abierto (OLE) a largo plazo de CHAMPION-MG utilizado para evaluar la seguridad y eficacia a largo plazo de ULTOMIRIS® durante 164 semanas (período aleatorizado controlado de 26 semanas; 138 semanas OLE) (N = 161).3
b) Grupo ULTOMIRIS®-ULTOMIRIS®: Variación media de MC con respecto al valor basal del PCR en la Semana 164: -4,0 (IC 95% -5,3, -2,8), P<0,0001. Grupo placebo-ULTOMIRIS®: Variación media de MC con respecto al valor basal de la OLE en la Semana 2 de la OLE: -1,8 (IC 95% -2,6, -1,0), P<0,0001.3
IC: intervalo de confianza; LS: mínimos cuadrados; MG-ADL: escala de actividades de la vida diaria en miastenia gravis; OLE: Open Label Extension (extensión abierta a largo plazo).
En el período de extensión abierto, un 63% de los pacientes tratados con ULTOMIRIS® redujeron o mantuvieron los niveles de corticoesteroides ≤ 10 mg/día y un 12% abandonó por completo el tratamiento con corticoesteroides*†3
* 113 pacientes recibieron corticoesteroides orales o enterales durante el período de extensión abierto, 71 pacientes tratados con ULTOMIRIS® redujeron o mantuvieron los niveles de corticoesteroides ≤10 mg/día y 14 pacientes suspendieron el tratamiento con corticoesteroides por completo.3
† En pacientes seguidos durante 164 semanas en el período de extensión abierto (N = 161).3
El período de extensión abierto se inició después de la semana 26, cuando todos los pacientes recibieron ULTOMIRIS®, y los resultados se observaron hasta la semana 164.*3
Figura de: Vu T, et al. Poster presented at: American Academy of Neurology (AAN) Annual Meeting; April 13-18, 2024; Denver, CO.3
* Los pacientes fueron distribuidos alatoriamente para recibir ULTOMIRIS® (n=86) o placebo (n = 89) durante 26 semanas y posteriormente, se les permitió entrar en el período de extensión abierta de hasta 4 años.2
BL: valor basal; IC: intervalo de confianza; LS: mínimos cuadrados; OLE: Open Label Extension (extensión abierta a largo plazo); QMG: miastenia gravis quantitativa; PCR: período controlado randomizado; DE: desviación estándar.
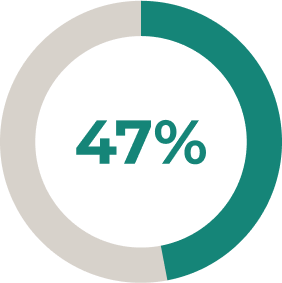
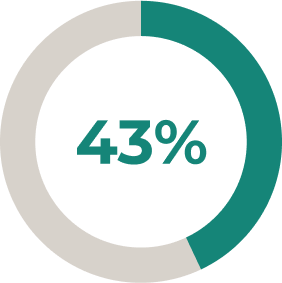
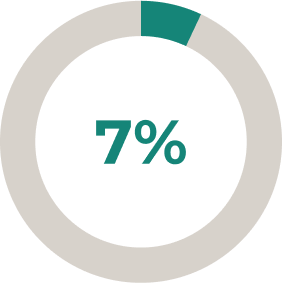
ULTOMIRIS®: una mayor proporción de pacientes logró mejoras clínicamente significativas en la puntuación total de QMG frente a placebo*2
El 30 % (n = 27/76) de los pacientes tratados con ULTOMIRIS® tuvieron una mejora de ≥ 5 puntos en la puntuación total de QMG frente al 11,3 % (n = 10/78) que recibieron placebo (P = 0,005).2
Figura de: Vu T, et al. N Eng J Med Evid. 2022; 1(5).2
* Se permitió la administración de dosis estables de inhibidores de la acetilcolinesterasa y tratamientos inmunosupresores (incluidos corticosteroides) durante el período controlado aleatorizado.2
QMG: escala cuantitativa de miastenia gravis- Variación de la puntuación MG-QOL15r en la semana 26 respecto al valor inicial: –3,3 para ULTOMIRIS® y –1,6 para placebo
- Variación de la puntuación de Neuro-QoL-Fatiga en la semana 26 respecto al valor inicial: –7,0 para ULTOMIRIS® y –4,8 para placebo
- Ninguno de estos criterios de valoración fue estadísticamente significativo
- Más pacientes tratados con ULTOMIRIS® lograron una mejora de ≥ 3 puntos en la puntuación total de MG-ADL frente a placebo
- El 57 % (n = 47/78) de los pacientes tratados con ULTOMIRIS® tuvieron una mejora de ≥ 3 puntos en la puntuación total de MG-ADL frente al 34 % (n = 30/82) de los pacientes con placebo; su significancia estadística no fue analizada.†
- Variación en la puntuación total de la escala MG-ADL entre el momento inicial y la semana 26 (comunicada por el paciente)*
- En la semana 26, variación de la puntuación total QMG con respecto al valor inicial§1d
- Mejoría de la puntuación total QMG ≥ 5 puntos con respecto al valor inicial§1d
- Variación de la puntuación MG-QOL15r con respecto al valor inicial2
- Variación de la puntuación de Neuro-QoL-Fatiga con respecto al momento inicial2
- Mejoría de la puntuación total MG-ADL ≥ 3 puntos con respecto al valor inicial1
† Las pruebas jerárquicas se realizaron del primer al quinto criterio de valoración secundario. Al no alcanzar la significación estadística (P-valor > 0,05) en el tercer criterio de valoración, no se analizó la significancia estadística de los criterios de valoración posteriores.2
‡ Las variables secundarias evaluaron los cambios des del inicio hasta la semana 26.1
§ La QMG es una escala categórica de 13 ítems que evalúa la debilidad muscular. Cada ítem se evalúa en una escala de 4 puntos, en la que una puntuación de 0 representa ausencia de debilidad y una puntuación de 3 representa debilidad intensa. La puntuación total oscila entre 0 y 39, y las puntuaciones más altas indican un deterioro más grave.2
MGg: miastenia gravis generalizada; MG–ADL: escala de actividades de la vida diaria en miastenia gravis; MGFA: Myasthenia Gravis Foundation of America; MG–QoL15r: escala de calidad de vida en la miastenia gravis de 15 ítems revisados; Neuro–QoL: escala de calidad de vida neurológica; QMG: escala cuantitativa de la miastenia gravis.
Los pacientes que alcanzan un estado de manifestación mínima de la enfermedad pueden ser más capaces de realizar las actividades cotidianas.4
Para acceder a la Ficha Técnica de ULTOMIRIS®, haz click aquí.
PRESENTACIÓN Y PRECIO.
Ultomiris 300 mg/3 ml concentrado para solución para perfusión, 1 vial de 3 ml. C.N: 731120. PVL notificado: 5.018 €. Ultomiris 1100 mg/11 ml concentrado para solución para perfusión, 1 vial de 11 ml. C.N: 731121. PVL notificado: 18.399,33 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. La indicación de Trastorno del espectro de neuromielitis óptica (TENMO) no está incluida en la prestación farmacéutica del Sistema Nacional de Salud.
RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN.
Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.

- En todas las indicaciones, las reacciones adversas más comunes son diarrea, infección del tracto respiratorio superior, nasofaringitis y dolor de cabeza1
- Durante los ensayos clínicos, las reacciones adversas más graves reportadas fueron infecciones meningocócicas y sepsis meningocócica, pero se reportaron en < 1 % de los pacientes1
* En miastenia gravis generalizada, hemoglobinuria paroxística nocturna (HPN), síndrome urémico hemolítico atípico (SHUa) y trastorno del espectro de neuromielitis óptica con anticuerpos acuaporina-4 positivos (TENMO AQP4 Ab+)1
AChR: receptor de acetilcolina; SHUa: síndrome urémico hemolítico atípico; AQP4 Ab+ TENMO: trastorno del espectro de neuromielitis óptica positivo para anticuerpos acuaporina-4; C5: componente 5 del complemento; MGg: miastenia gravis generalizada; HPN: hemoglobinuria paroxística nocturna.
- Se informaron eventos adversos graves en 20 (23%) pacientes con MGg tratados con ULTOMIRIS® y en 14 (16%) pacientes que recibieron placebo2
- Los eventos adversos graves más frecuentes estuvieron relacionados con el empeoramiento de la MGg (1 paciente tratado con ULTOMIRIS® y 3 pacientes con placebo) y COVID-19 (2 pacientes tratados con ULTOMIRIS® y 1 que recibió placebo)2
En todas las indicaciones, las reacciones adversas más frecuentes (muy frecuente, ≥ 1/10) son diarrea, infección del tracto respiratorio superior, nasofaringitis y dolor de cabeza.1
MGg: miastenia gravis.
Para acceder a la Ficha Técnica de ULTOMIRIS®, haz click aquí.
PRESENTACIÓN Y PRECIO. Ultomiris 300 mg/3 ml concentrado para solución para perfusión, 1 vial de 3 ml. C.N: 731120. PVL notificado: 5.018 €. Ultomiris 1100 mg/11 ml concentrado para solución para perfusión, 1 vial de 11 ml. C.N: 731121. PVL notificado: 18.399,33 €. Financiación por el S.N.S para determinadas indicaciones/condiciones. La indicación de Trastorno del espectro de neuromielitis óptica (TENMO) no está incluida en la prestación farmacéutica del Sistema Nacional de Salud.RÉGIMEN DE PRESCRIPCIÓN Y DISPENSACIÓN Medicamento sujeto a prescripción médica. Uso Hospitalario. Consulte la Ficha Técnica completa antes de prescribir este medicamento.

profesional sanitario
